在當前的腫瘤****中,納武利尤單抗、帕博利珠單抗等**檢查點抑制劑取得了不錯的**效果,然而**耐藥使多數患者不能實現長期生存[1]。****通過激活機體**系統對抗腫瘤的同時,腫瘤自身也會通過功能及代謝重編程導致**抵抗的發生[2]。
**檢查點抑制劑主要依靠腫瘤細胞自身PD-L1的表達,及具有腫瘤識別和殺傷作用的CD8+T細胞的浸潤發揮抗腫瘤作用,腫瘤內CD8+T細胞的浸潤程度與**檢查點抑制劑的**緩解率呈正相關[3]。
如何提高腫瘤微環境中CD8+T細胞的浸潤程度,解除**抑制性腫瘤微環境,使“冷腫瘤”變為“熱腫瘤”以增強抗腫瘤**,是當前研究的重要方向。
近日,由瑞士巴塞爾大學附屬醫院生物醫學中心的Heinz L?ubli教授及Michal A. Stanczak教授帶領的研究團隊在Science Translational Medicine期刊發表重要研究成果[4]
該研究發現,唾液酸聚糖在腫瘤微環境中豐度較高,靶向腫瘤微環境中的唾液酸聚糖及其配體可促進TAMs發生M1極化,增強CD8+T細胞功能,并可增強PD-1抑制劑與CTLA-4抑制劑的聯合**效果,因此降低腫瘤微環境中的唾液酸聚糖水平是一種重塑巨噬細胞表型、增強適應性抗腫瘤**反應的有效方法。
腫瘤微環境中唾液酸聚糖分子豐度較高,呈高唾液酸化水平,其可與腫瘤浸潤**細胞上的唾液酸結合性**球蛋白樣凝集素(Siglec)結合,從而形成**抑制性的腫瘤微環境,損傷抗腫瘤**[5]。
**系統中Siglec家族含有多種Siglec分子,均呈現不同的表達譜。研究發現腫瘤相關巨噬細胞(TAMs)表達CD33相關的抑制性Siglec分子,人源性的Siglec-7、Siglec-9及鼠源性的Siglec-E均可促進M2極化進而導致腫瘤進展;此外,Siglec-7、Siglec-9還可抑制NK細胞及腫瘤浸潤性T細胞的腫瘤殺傷作用[6]。
研究表明,靶向唾液酸聚糖-Siglec軸可活化固有**及適應性**[6]。然而,靶向該調控軸的具體機制仍不明確,具體的干預手段亦需要進一步探索。
首先,研究人員通過TCGA數據庫及臨床樣本發現,腫瘤微環境中較高的唾液酸聚糖水平往往伴隨著較短的生存時間,同時還與**抑制性腫瘤微環境的形成,以及T細胞功能失調相關。為了進一步驗證上述結果,研究人員通過基因編輯,對結腸癌細胞系MC-38中唾液酸聚糖合成限速酶GNE進行了基因敲除。
通過GNE敲除的MC-38細胞系的CDX模型,研究人員發現,低唾液酸水平可顯著抑制腫瘤生長,甚至可使腫瘤消退;同時,低唾液酸水平還可使CD8+T細胞中IFN-γ及TNF的表達量上升。聯合**檢查點抑制劑干預后,GNE敲除對腫瘤生長的抑制作用,以及對CD8+T細胞功能的促進可進一步增強
接下來研究人員成功構建了唾液酸酶-曲妥珠單抗融合蛋白E-301,以實現對HER2陽性腫瘤微環境中唾液酸聚糖的降解。為了檢測E-301的**效果,研究人員構建了HER2陽性的EMT6乳腺癌細胞系及B16D5黑色素瘤細胞系的CDX模型。研究人員發現,E-301干預可顯著抑制CDX腫瘤的生長,顯著延長CDX小鼠的生存時間,并未導致毒性反應的發生。
與此同時,CD8+T細胞的去除可抵消E-301對腫瘤生長的抑制作用,這就表明E-301可通過激活適應性**抑制腫瘤的生長。此外,研究人員還發現E-301的唾液酸聚糖降解作用發生在包括TAMs在內的幾乎所有的**細胞中,主要降解N端唾液酸化的聚糖分子。
為了進一步明確腫瘤微環境中唾液酸聚糖降解對腫瘤浸潤性**細胞的影響,研究人員對CDX腫瘤組織中的腫瘤浸潤性**細胞進行了單細胞RNA測序分析。分析結果表明,E-301聯合**檢查點抑制劑干預后,TAMs中M1的比例增加,而M2的比例呈下降趨勢。
研究人員又對CDX腫瘤組織進行了流式細胞術分析,發現E-301干預后表達CD80的M1型TAMs比例升高,而表達CD206的M2型TAMs比例減少;此外,E-301干預還可導致CD8+T細胞的激活標志物CD25與功能標志物顆粒酶B的表達水平的升高。通過體外的腫瘤細胞與巨噬細胞的共培養模型,研究人員也證實腫瘤微環境中唾液酸聚糖的降解可促進TAMs發生M1極化、增強CD8+T細胞的功能。
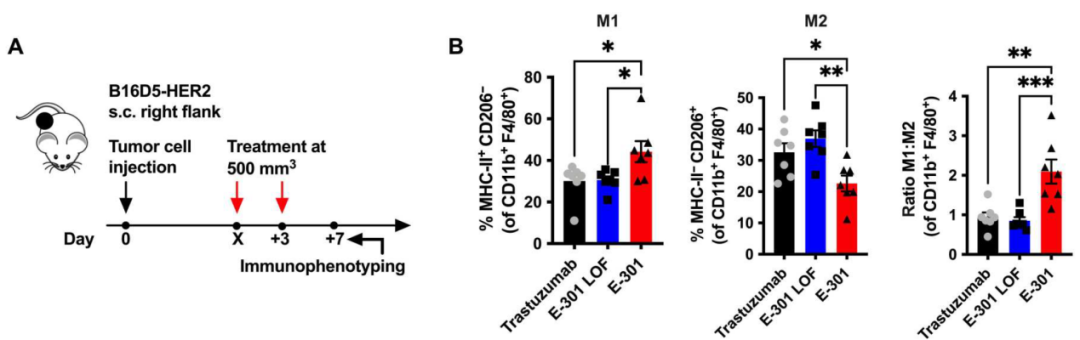
E-301、E-301失活體及曲妥珠單抗干預下TAMs中M1、M2及M1/M2比率的改變情況
為了探究唾液酸聚糖的降解是如何導致TAMs發生M1極化的,研究人員將注意力轉移到了TAMs表面的唾液酸聚糖受體Siglec分子上。
結合之前的單細胞測序數據,研究人員發現在Siglec家族中,Siglec-E在TAMs中的表達占主導地位;CDX小鼠TAMs表面Siglec-E的缺失可抑制腫瘤的生長,并促進M1型TAMs數目的增加及CD8+T細胞中CD25的表達,同時還可削弱E-301對腫瘤的抑制作用以及對M1及CD8+T細胞的促進作用。
這些現象說明,腫瘤微環境中的唾液酸聚糖是依賴于TAMs表面的Siglec-E發揮作用的。*后,研究人員證實腫瘤細胞中唾液酸聚糖合成限速酶GNE的敲除,可降解腫瘤微環境中唾液酸聚糖的E-301的干預以及TAMs表面唾液酸聚糖配體Siglec-E的敲除,均可增強PD-1抑制劑與CTLA-4抑制劑的聯合**療效。
總的來說,腫瘤微環境中大量存在的唾液酸聚糖可與TAMs表面的Siglec-E結合,促進其發生M2極化,靶向唾液酸聚糖-Siglec軸就可以解除這種**抑制性微環境,促使TAMs發生M1極化,增強CD8+T細胞功能,并增敏**檢查點抑制劑。同時,體內試驗的結果也證實腫瘤微環境中唾液酸聚糖的降解可進一步增強PD-1抑制劑與CTLA-4抑制劑的聯合**效果。
這項研究為腫瘤微環境中高唾液酸水平介導的**抑制提供了機制證據,證明了唾液酸聚糖降解作為潛在腫瘤**方法的有效性和可行性,并強調了其與經典**檢查點抑制劑聯合使用的潛力。
