核孔復(fù)合體(nuclear pore complex, NPC)位于核膜(NE)上,介導(dǎo)細(xì)胞核-細(xì)胞質(zhì)貨物運(yùn)輸。作為細(xì)胞中*大的分子機(jī)器之一,脊椎動(dòng)物NPC由細(xì)胞質(zhì)絲(cytoplasmic filament)、細(xì)胞質(zhì)環(huán)(cytoplasmic ring, CR)、內(nèi)環(huán)(inner ring)、核環(huán)(nuclear ring)、核籃(nuclear basket)和管狀環(huán)(luminal ring)組成。每個(gè)NPC有八個(gè)重復(fù)的亞基。NPC的結(jié)構(gòu)測(cè)定是了解其功能機(jī)制的先決條件。在過去的二十年里,綜合建模,即把核孔蛋白(nucleoporin, Nup)和亞復(fù)合物的X射線結(jié)構(gòu)與低溫電子斷層掃描重建相結(jié)合,在推進(jìn)人們對(duì)NPC的認(rèn)識(shí)方面發(fā)揮了關(guān)鍵作用。
CR一直是結(jié)構(gòu)研究的一個(gè)主要焦點(diǎn)。人類NPC的CR亞基通過低溫電子斷層成像技術(shù)進(jìn)行子斷層掃描圖平均化(subtomogram averaging)而得到重建,其整體分辨率為約20埃,局部分辨率為約15埃。每個(gè)CR亞基包括兩個(gè)Y型多組分復(fù)合體,稱為內(nèi)側(cè)Y復(fù)合體和外側(cè)Y復(fù)合體。八個(gè)內(nèi)側(cè)和八個(gè)外側(cè)的Y復(fù)合體以頭到尾的方式組合在一起,分別形成近端和遠(yuǎn)端環(huán),構(gòu)成了CR支架。為了實(shí)現(xiàn)更高的CR分辨率,來自中國西湖大學(xué)的施一公課題組在一項(xiàng)新的研究中使用單顆粒低溫電鏡(cryo-EM)對(duì)來自非洲爪蟾卵母細(xì)胞核膜的完整NPC進(jìn)行成像。對(duì)非洲爪蟾CR亞基的核心區(qū)域和Nup358區(qū)域的重建達(dá)到了5~8埃的平均分辨率,從而可以識(shí)別二級(jí)結(jié)構(gòu)元件。相關(guān)研究結(jié)果發(fā)表在2022年6月10日的Science期刊上,論文標(biāo)題為“Structure of the cytoplasmic ring of the Xenopus laevis nuclear pore complex”。

以前所有的電鏡圖都不能很好地確定CR亞基各組分之間的堆積相互作用。5~8埃的電鏡圖強(qiáng)烈地提示著了CR亞基存在其他組分,但仍有待確定。解決這些問題需要提高低溫電鏡重建的分辨率。因此,這些作者可能需要改善樣品制備,優(yōu)化圖像采集,并開發(fā)一種有效的數(shù)據(jù)處理策略。
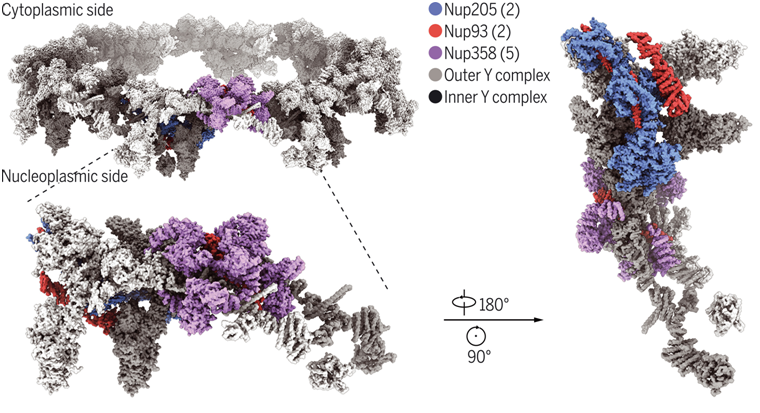
為了減少樣品的構(gòu)象異質(zhì)性,這些作者用*小的力將打開的核膜鋪到網(wǎng)格上,并使用化學(xué)交聯(lián)劑戊二醛來穩(wěn)定NPC。為了減輕NPC的方向偏差,他們讓樣品網(wǎng)格發(fā)生傾斜,并在較高的角度用較高的電子劑量對(duì)樣品進(jìn)行成像。他們改進(jìn)了圖像處理流程。通過這些努力,CR亞基的核心區(qū)域和Nup358區(qū)域的平均分辨率分別提高到3.7埃和4.7埃。此外,Nup358的N末端α-螺旋結(jié)構(gòu)域的低溫電鏡結(jié)構(gòu)達(dá)到3.0埃的分辨率。這些電鏡圖允許在每個(gè)CR亞基中識(shí)別5個(gè)Nup358拷貝、2個(gè)Nup93拷貝、2個(gè)Nup205拷貝和2個(gè)Y復(fù)合體。依靠這些電鏡圖并在AlphaFold預(yù)測(cè)的幫助下,他們?yōu)榉侵拮窷PC的CR亞基生成了一個(gè)*終模型。他們的CR亞基模型包括30個(gè)Nup的19037個(gè)氨基酸。
非洲爪蟾NPC雙層CR的低溫電鏡結(jié)構(gòu)。圖片來自Science, 2022, doi:10.1126/science.abl8280。
這些作者發(fā)現(xiàn)Nup160的一個(gè)以前未知的C末端片段構(gòu)成了一個(gè)頂點(diǎn)(vertex)的關(guān)鍵部分,Y復(fù)合體的短臂、長臂和莖部在個(gè)頂點(diǎn)相遇。Nup160的C末端片段直接與β推進(jìn)蛋白Seh1和Sec13結(jié)合。兩個(gè)彼此不接觸的Nup205分子通過不同的界面與內(nèi)側(cè)和內(nèi)側(cè)的Y復(fù)合體結(jié)合。兩個(gè)Nup205分子的構(gòu)象彈性可能是它們與近端和遠(yuǎn)端CR環(huán)中不同Nup結(jié)合的多樣性的基礎(chǔ)。兩個(gè)Nup93分子,每個(gè)都包括一個(gè)N端延伸螺旋和一個(gè)ACE1結(jié)構(gòu)域,連接內(nèi)側(cè)和內(nèi)側(cè)的Y復(fù)合體和Nup205。Nup93和Nup205一起在介導(dǎo)相鄰的CR亞基之間的接觸中發(fā)揮了關(guān)鍵作用。五個(gè)Nup358分子,呈蝦尾形狀,被命名為“鉗子(clamp)”,夾住這兩個(gè)Y復(fù)合體的莖部。這種先天的構(gòu)象彈性使每個(gè)Nup358鉗子能夠適應(yīng)不同的局部環(huán)境,以實(shí)現(xiàn)與相鄰Nup的*佳相互作用。在每個(gè)CR亞基中,α螺旋狀的Nup似乎提供了構(gòu)象彈性;12個(gè)β推進(jìn)蛋白可能加強(qiáng)了CR支架的作用。
???上所述,這些作者構(gòu)建出的基于電鏡圖的非洲爪蟾CR亞基模型比已報(bào)道的脊椎動(dòng)物CR亞基的復(fù)合模型大大擴(kuò)展了分子質(zhì)量。除了這兩個(gè)Y復(fù)合體外,五個(gè)Nup358、兩個(gè)Nup205和兩個(gè)Nup93分子構(gòu)成了CR的關(guān)鍵組分。這些改進(jìn)后的電鏡圖揭示了對(duì)CR中不同Nup之間的界面的新見解。(生物谷 Bioon.com)
