NLRP3炎性小體與無菌和病原體依賴性的炎癥發生有關,其功能失調是引發多種慢性**的原因和基礎�����,線粒體能通過參與包括產生線粒體活性氧(ROS)在內的多種機制來被認為是NLRP3炎性小體的調節子�����。
近日,一篇發表在國際雜志Nature Immunology上題為“Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation”的研究報告中,來自美國西北大學的研究人員通過研究發現�����,線粒體的呼吸鏈或許對于與炎癥和慢性**進展相關的另一種蛋白復合體的激活非常必要,線粒體的呼吸鏈是一系列對于細胞呼吸和能量產生非常重要的蛋白質復合體。
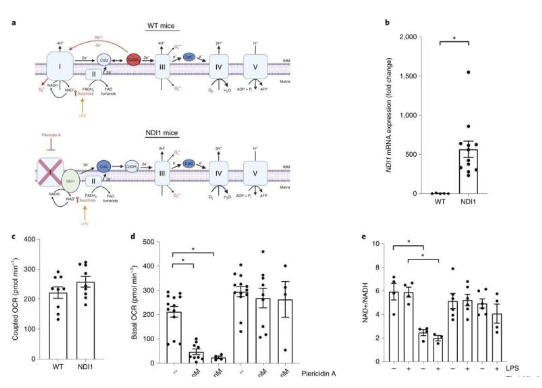
線粒體的呼吸鏈或能維持機體的炎癥水平����。
原始出處:Nature Immunology (2022). DOI: 10.1038/s41590-
022-01185-3
研究者Navdeep Chandel說道����,本文研究表明����,抑制線粒體的呼吸鏈或能在遺傳上和藥理學上抑制NLRP3炎性小體的激活����,該炎性小體是一種蛋白復合體����,其能被病毒或**感染所激活����,而且能通過誘發促炎性細胞因子的釋放來引發組織損傷以及多種慢性**的進展����,包括肥胖����、阿爾茲海默病和2型糖尿病等����。此前研究結果表明,NLRP3炎性小體能被線粒體所調節����,尤其是通過產生線粒體活性氧,尤其是超氧化物和過氧化氫�。
當前研究中,研究者Chandel及其同事利用遺傳測序技術及藥理學策略研究了巨噬細胞(尤其是白細胞)��,并分析了線粒體ROS對于激活NLRP3炎性小體的必要性���。讓他們驚訝的是,線粒體ROS并不是必需的,此外��,線粒體呼吸鏈復合體I, II, III和V的抑制劑還能阻斷NLRP3炎性小體的激活�,這些呼吸鏈對于細胞內能量的正常產生非常重要����。此外��,研究者還發現,正常情況下能在機體中產生且作為廣泛使用的營養補充劑的肌酸(creatine)或能增強磷酸肌酸(phosphocreatine)的產生����,后者對于細胞內正常的能量產生非常重要���,且會被呼吸鏈抑制劑所耗盡���,而呼吸鏈抑制劑反而會維持炎性小體的激活����。

原始出處:https://pubmed.ncbi.nlm.nih.gov/35484407/
研究者Chandel說道,本文研究結果表明�����,肌酸和磷酸肌酸或與機體炎癥發生直接相關,這或許就為進一步研究肌酸的作用機制開辟了一條新的路徑��。目前的研究結果強調了,線粒體的呼吸鏈或能通過磷酸肌酸依賴性的能量產生來維持NLRP3炎性小體的激活��,且完全獨立于線粒體ROS的作用���。目前研究人員非常感興趣研究在流感和阿爾茲海默病背景下線粒體控制炎癥的分子機制。
本文研究中���,研究人員提出的研究工具和概念框架或許也能幫助他們分析線粒體如何在不同**中調節多種細胞因子的功能����。綜上�,本文研究結果表明�,線粒體中的電子傳遞鏈或能通過磷酸肌酸依賴性的ATP產生來維持NLRP3炎性???體的激活,但卻獨立于ROS依賴性的機制。(生物谷Bioon.com)
